- Иммунологические и патофизиологические особенности недостаточности трансплантата роговицы
- Факторы риска отторжения роговицы после кератопластики
- Методики и виды кератопластик
- Прогноз операции
- Потенциальные мишени для таргетной иммунотерапии кератопластики «высокого риска»
- Трансплантационный материал
 Патология роговицы, возникающая в результате травм, ожогов, дистрофических и дегенеративных заболеваний, является на сегодняшний день значительной проблемой в офтальмологии. Основным решением данной проблемы служит хирургическая операция – кератопластика, при которой поврежденный участок роговицы пациента заменяется трансплантатом донора. Известно, что результаты кератопластики в значительной степени зависят от этиологии патологии роговицы. Так, у пациентов с кератоконусом и с некоторыми формами дистрофии роговицы вероятность успешного приживления трансплантата довольно высока и составляет почти 90%.
Патология роговицы, возникающая в результате травм, ожогов, дистрофических и дегенеративных заболеваний, является на сегодняшний день значительной проблемой в офтальмологии. Основным решением данной проблемы служит хирургическая операция – кератопластика, при которой поврежденный участок роговицы пациента заменяется трансплантатом донора. Известно, что результаты кератопластики в значительной степени зависят от этиологии патологии роговицы. Так, у пациентов с кератоконусом и с некоторыми формами дистрофии роговицы вероятность успешного приживления трансплантата довольно высока и составляет почти 90%.
Под кератопластикой следует понимать хирургические операции на роговице, направленные на восстановление ее формы и функций, устранение врожденных и приобретенных после травм и болезней дефектов и деформаций с использованием различных методов трансплантации.
Трансплантация роговицы - пересадка (перемещение) роговицы с последующим приживлением ее в пределах одного организма, или от одного организма другому того же вида, или даже другого вида.
Таким образом получается, что при кератопластике хотя и используется трансплантат, однако не обязательно роговичный. Сам же роговичный трансплантат может использоваться также для роговичной, склеральной, конъюнктивальной и других видов пластик. Иными словами, когда мы употребляем термин трансплантация роговицы то имеем ввиду, что пересаживаем роговицу, термином же кератопластика уточняем, что пересаживаем на роговицу.
Данные о частоте отторжения роговичного трансплантата в различных исследованиях варьируют от 2,3 до 68%.
Иммунологические и патофизиологические особенности недостаточности трансплантата роговицы
Успех кератопластики относительно трансплантаций других органов и тканей заключается в особом механизме, реализуемом посредством локальной и системной иммунорегуляции, – иммунной привилегии глаза. Тем не менее идея изоляции глаза от иммунной системы в настоящее время рассматривается на основе феномена, известного как иммунное отклонение, связанное с передней камерой глаза (Anterior Chamber Associated Immune Deviation – ACAID). Данное состояние поддерживается антигенпрезентирующими клетками (АПК), мигрирующими из глаза в лимфатические узлы и индуцирующими специфические регуляторные Т-лимфоциты, которые системно подавляют отторжение трансплантата. Кроме того, одна из стратегий сохранения иммунной привилегии глаза заключается в существовании иммуносупресcивной внутриглазной микросреды.
Основным механизмом иммунологического распознавания является система HLA (Human Leukocyte Antigens – человеческие лейкоцитарные антигены), осуществляющая контроль трансплантационных антигенов, синтез поверхностных клеточных молекул и формирование иммунного ответа. К I классу относятся классические антигены – A, B и C (Ia), и неклассические, включающие HLA-E, HLA-F и HLA-G (Ib) молекулы. В ряде исследований было показано, что антигены HLA-G способны регулировать баланс провоспалительных (TNF-α) и противовоспалительных (IL-10) цитокинов путем сдвига в сторону последних. В то же время установлено, что IL-10 повышает уровень транскрипции гена HLA-G в клеточных культурах трофобластов и положительно регулирует клеточную поверхностную экспрессию HLA-G в моноцитах периферической крови, а экзогенно введенный IL-10 индуцирует секрецию растворимого HLA-G мультипотентными мезенхимными стволовыми клетками (ММСК).
В основе иммуноопосредованного отторжения трансплантата лежит сложная взаимосвязь между лимфангиогенезом (афферентным звеном), гемангиогенезом (эфферентным звеном) и воспалением, что в конечном итоге приводит к потере иммунной привилегии роговицы. Аваскулярная природа роговицы, уникальная физиология передней камеры, низкая или отсутствующая экспрессия антигенов гистосовместимости I и II класса в клетках роговицы, покоящиеся АПК и присутствие апоптотических факторов Т-клеток, таких как Fas-лиганды, являются критериями высокой выживаемости аллотрансплантатов роговицы. Процесс отторжения кератотрансплантата включает фазу индукции, которая начинается с сенсибилизации хозяина к донорским антигенам и активации АПК, которые, в свою очередь, сенсибилизируют и индуцируют пролиферацию Т-клеток в дренирующих лимфатических узлах. Эфферентная фаза, опосредованная доставкой иммунных эффекторов кровеносными сосудами к участку трансплантата, ответственна за конечную атаку донорского материала через эффекторный механизм CD8+- и CD4+-T-клеток, которые вырабатывают воспалительные цитокины (IL-2, IFN-γ, IL-4 и IL-10), что впоследствии приводит к отторжению трансплантата.
Исследование уровня цитокинов в слезной жидкости и/или в сыворотке крови может быть одним из способов прогнозирования характера течения послеоперационного периода и своевременной диагностики осложнений. Известно, что в ответ на хирургическое вмешательство при кератопластике происходит выброс цитокинов IL-1β, TNF-α, IL-4, IL-0, а также наблюдается повышение уровня IL-2 и/или IFN-γв сыворотке крови в раннем послеоперационном периоде.
На долю иммунного отторжения приходится более 50% случаев нарушений его нормального функционирования. К неиммунным причинам недостаточности кератотрансплантата относят глаукому (10%), воспалительные заболевания глаза (10%), эндотелиальную клеточную недостаточность (8%) и герпетическую инфекцию (7%). Причины оставшихся случаев нередко остаются невыясненными.
Снижение плотности эндотелиальных клеток роговицы, которое может возникнуть через несколько лет после трансплантации роговицы, также опосредовано факторами иммунной системы. В многочисленных исследованиях было показано, что на поверхности эндотелия трансплантированной роговицы присутствуют клетки иммунной системы: дендритные, CD4+-T-хелперные клетки, CD8+-цитотоксические T-клетки, CD20+-B-лимфоциты, CD68+-макрофаги и нейтрофилы [18–19]. В эксперименте на кроликах с помощью конфокальной сканирующей микроскопии было описано, что главной причиной поздней эндотелиальной недостаточности являлись иммунные клетки, которые продуцировали провоспалительные цитокины TNF-α и IFN-γ. При этом некоторые эндотелиальные клетки роговицы, расположенные рядом с этими иммунными клетками, проявляли признаки апоптоза.
Факторы риска отторжения роговицы после кератопластики
При подготовке пациентов к кератопластике, а также в послеоперационном периоде необходимо учитывать факторы риска формирования несостоятельности трансплантата роговицы. На функциональную состоятельность кератотрансплантата значительное влияние оказывает несовместимость донора и реципиента по системе АВ0 и генотипу HLA. Анализ 199 сквозных кератопластик показал, что в группе высокого риска «выживаемость» трансплантата была выше в AB0-совместимой подгруппе (p=0,0002). В группе низкого риска «выживаемость» трансплантата в обеих подгруппах была сходной.
Совместимость по генотипу HLA может положительно влиять на приживление роговичного трансплантата. Однако необходимость соответствия HLA-антигенов ставится под сомнение: в экспериментах с использованием мышиных моделей было показано, что «минорные» (H) антигены HLA могут быть более значимыми при отторжении трансплантата, чем основной комплекс гистосовместимости.
Такие факторы, как метод консервации донорской роговицы, причина смерти донора, не оказывают значительного влияния на результат кератопластики. Однако в исследовании M. Simon и соавт. (2004) анализ 210 случаев аллотрансплантации роговиц показал, что хранение ткани роговицы в среде при температуре 37 °C (тепловая консервация) может снизить частоту отторжения аллотрансплантата.
Другими исследованиями было отмечено, что при гендерной несовместимости трансплантация роговицы связана с более высоким риском отторжения кератотрансплантата. При этом время между различными этапами подготовки кератотрансплантата не влияет на риск отторжения, но может повлиять на его качество.
Одним из основных факторов риска отторжения роговичного аллотрансплантата является степень васкуляризации воспринимающего ложа реципиента. У пациентов с кератопластикой «низкого риска» разрастание кровеносных и лимфатических сосудов после трансплантации быстро ингибируется, и ангиогенное привилегированное состояние роговицы восстанавливается. При кератопластике «высокого риска» наблюдается утрата данной ангиогенной привилегии: по лимфатическим сосудам происходит транспорт антигенов трансплантата для антигенпрезентации Т-клеткам в лимфоузлах; по кровеносным сосудам осуществляется доставка иммунных эффекторных клеток в место имплантации, что индуцирует иммунное отторжение. При этом степень и глубина васкуляризации прямо пропорциональны увеличению риска отторжения аллотрансплантата.
Повторные пересадки роговицы также неблагоприятно влияют на состоятельность кератотрансплантата. Вероятность отторжения трансплантата после первой пересадки составляет около 40%, после второй – 68%, после третьей – 80%. К возможным причинам несостоятельности роговицы в этом случае относят пресенсибилизацию, формирование иммунологической памяти, воспаление и васкуляризацию, вызванные предыдущими хирургическими вмешательствами.
В значительной степени к отторжению аллотрансплантата роговицы или его недостаточности по неиммунологическим причинам предрасполагает острое интраоперационное инфекционное воспаление, так называемая «горячая трансплантация». Кроме того, риск возникновения иммунных реакций увеличивает наличие таких заболеваний, как атопический дерматит и экзема, герпетический кератит, увеит, глаукома, синдром «сухого глаза», а также предыдущие операции на переднем отрезке глаза.
Кроме того, у кандидатов на трансплантацию важно учитывать низкое количество лимбальных стволовых клеток из-за деградации лимбальных палисадов Фогта, поскольку это может привести к плохой реэпителизации в послеоперационном периоде и развитию хронического воспаления, рецидивирующей эрозии и конъюнктивизации. С целью профилактики отторжения в данном случае необходимо своевременно выявлять бокаловидные клетки в роговице методом цитологического анализа отпечатков. Тотальную сквозную кератопластику связывают с более высоким риском отторжения трансплантата из-за его большего диаметра и увеличения доступности к лимбальной сосудистой сети. Послойная кератопластика, при которой заменяется только пораженная часть роговицы, обеспечивает достоверно лучшую выживаемость трансплантата.
Эндотелиальная кератопластика – одно из современных направлений трансплантации роговицы, заключается в трансплантации задних (эндотелиальных) слоев донорской роговицы. Операции такого типа показывают значительное преимущество, в том числе, в плане риска развития реакции иммунного отторжения (<1%), по сравнению со стандартной сквозной кератопластикой.
Методики и виды кератопластик
В основе деления кератопластик по видам лежат:
- площадь иссекаемого участка роговицы реципиента и используемого роговичного трансплантата;
- глубина вмешательства на роговице реципиента и толщина пересаживаемого трансплантата;
- цель операции.
 О размерах иссекаемого участка роговицы реципиента и пересаживаемого донорского роговичного трансплантата в подавляющем большинстве случаев судят по диаметрам используемых в процессе операции трепанов. Так, при нормальном размере роговицы (вертикальный - 11 мм, горизонтальный - 12 мм) больного, различают кератопластики
О размерах иссекаемого участка роговицы реципиента и пересаживаемого донорского роговичного трансплантата в подавляющем большинстве случаев судят по диаметрам используемых в процессе операции трепанов. Так, при нормальном размере роговицы (вертикальный - 11 мм, горизонтальный - 12 мм) больного, различают кератопластики
- частичные (до 6 мм в диаметре, как правило 4-6 мм),
- субтотальные (6,5-9 мм), когда остается на периферии собственная роговица больного, и
- тотальные (9,5-12 мм). При тотальных пересадках роговицы изредка используют трансплантаты с каймой склеры. Последняя необходима для фиксации трансплантата в пределах здоровой ткани (например, за склеру при ожогах).
Значительно реже, в зависимости от формы, величины и локализации патологического участка на роговице больного, офтальмохирург обходится без привычных трепанов, выкраивая другие геометрические фигуры (правильные и неправильные) на роговице больного. Однако и в этом случае, в зависимости от площади оставшейся собственной роговицы реципиента, можно говорить о частичной, субтотальной и тотальной кератопластике.
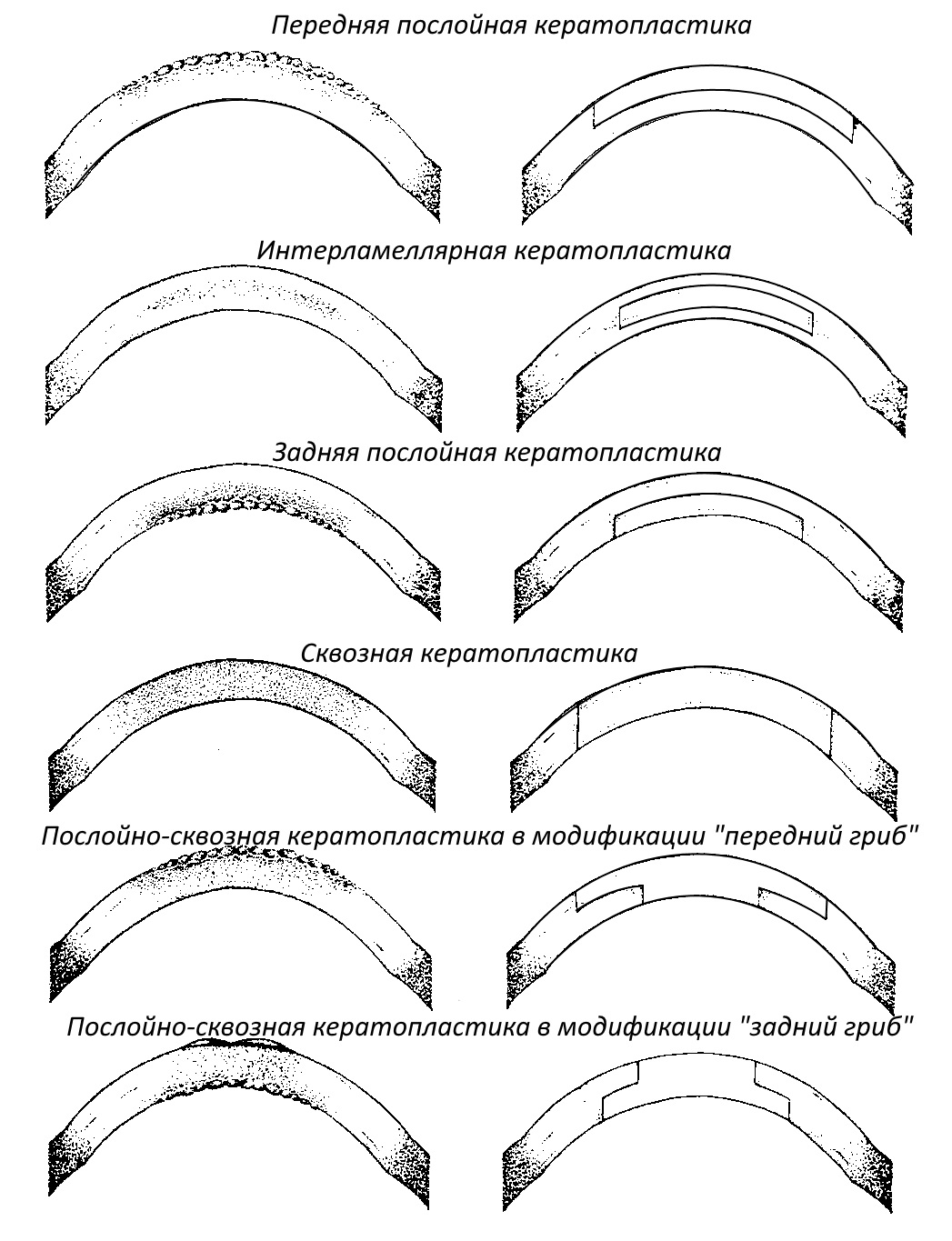
Послойными называются такие пластики роговицы, при которых трансплантатом замещается (либо восстанавливается) лишь часть ее слоев. В зависимости от глубины вмешательства и, следовательно, локализации замещаемых роговичных слоев, послойные кератопластики подразделяются на
- передняя послойная кератопластика (ППК), - замещаются (либо восстанавливаются) лишь передние слои роговицы, а задние (часть стромы, задняя пограничная мембрана, эндотелий) остаются нетронутыми.
- интерламеллярная послойная кератопластика (ИЛК) - замещается часть стромы,
- задняя послойняя кератопластика (ЗПК) - замещаются только задние слои.
В большинстве случаев для ППК выбирают трансплантаты диаметром 6-10 мм, для ИЛК- 5-7 мм и для ЗПК - 4-8 мм.
Задняя автоматизированная послойная кератопластика (ЗАПК или DSAEK)
В последние несколько лет операция задней автоматизированной послойной кератопластики – ЗАПК или DSAEK (англ.) – приобрела широкую популярность и на сегодняшний день признана стандартом хирургического лечения пациентов с дисфункцией эндотелия роговицы при отсутствии у них необратимой деструкции фибриллярных элементов стромы.
Общепринятая методика подготовки трансплантата для ЗАПК представляет собой его послойное выкраивание из корнеосклерального диска донорской роговицы, закрепленного в аппарате искусственной передней камеры при помощи автоматизированного микрокератома. При этом хирург выполняет один срез микрокератомом с использованием головок 300 либо 350 мкм, выбор которых осуществляется в зависимости от исходной толщины донорской роговицы. Конечная величина пахиметрии, измеренная в центральной зоне после выполнения среза, составляет в среднем 250 мкм и нередко варьирует в весьма широком диапазоне значений (от 180 до 350 мкм).
Этому способствуют колебания глубины среза, присущие всем типам головок микрокератома, вследствие отклонения их геометрических параметров от идеальных, а также наличие люфтов в соединениях. Вариабельность глубин срезов головки микрокератома также обусловлена параметрами внутрикамерного давления в системе фиксатора донорской роговицы и диаметром выкраиваемого лоскута. Следует отметить, что индивидуальные анатомические особенности донорского материала, включая сроки забора и особенности его хранения, также как и вид консервационной среды, задают разную исходную толщину роговицы. Прецизионное выкраивание трансплантата из донорской роговицы для ЗАПК требует от хирурга навыков работы с различными моделями микрокератомов, занимает большое количество времени и является трудоёмким. Также следует упомянуть фактор многочисленных дополнительных манипуляций, включая сборку микрокератома, установку донорской роговицы в искусственную переднюю камеру, многократное проведение ультразвуковой пахиметрии роговицы и ряд других.
В связи подготовка донорского материала стала выполняться заранее, в условиях специализированных учреждений, занимающихся забором и хранением донорских тканей – глазных тканевых банках. Это так называемая технология «pre-cut», или «предварительного реза». Результаты операций ЗАПК, выполненных с использованием донорских роговиц, подготовленных как хирургом во время операции, так и выкроенных в глазном банке, не выявили значимых различий по частоте развития осложнений и дали сравнимые клинико-функциональные результаты.
В настоящее время все большую популярность набирает технология ЗАПК, предполагающая формирование ультратонкого трансплантата (уЗАПК) с минимальной толщиной остаточной стромы (не более 130 мкм), что дает возможность получить существенный прирост зрительных функций по сравнению с традиционной технологией ЗАПК.
Однако, в зависимости от места положения роговичного трансплантата на поверхности глаза больного пересадки (но не кератопластики) делят на корнеальные (центральные и периферические, корнео-экстракорнеальные (роговично-склеральные) и склеральные. Периферические корнеальные и корнео-экстракорнеальные пересадки по их функциональному предназначению называют еще барьерными. ИЛК и ЗПК бывают только роговичными, так как трансплантация осуществляется в ложе, подготовленное в пределах роговицы больного. В интересах лучшего оптического эффекта трансплантаты располагают центрально.
Среди послойных кератопластик, применяемых с реконструктивной целью, выделяют накладные кератопластики (эпикератопластики), при которых послойный роговичный трансплантат располагается на деэпителизированнои поверхности роговицы без создания ложа в пределах оптической зоны.
Сквозными называются кератопластики, при которых трансплантатом замещается вся толща роговицы реципиента. В зависимости от размера используемого трансплантата сквозные кератопластики, также как и послойные, делятся на частичные, субтотальные и тотальные. Идеальным размером для оптической сквозной кератопластики является 7,5 мм центрированный трансплантат.
При частичной сквозной кератопластике чаще развивается неправильный астигматизм, существенно понижающий остроту зрения даже при идеально прозрачном приживлении трансплантата, а сохраняющаяся вокруг трансплантата большая зона собственной роговицы (зачастую генетически измененная) может способствовать в отдаленном периоде рецидиву заболевания и делать невозможным ношение корригирующей контактной линзы. Большие размеры трансплантатов при тотальной сквозной кератопластике ведут к повышению риска развития аллерго-иммунологических реакций, передним, иногда даже круговым, синехиям, ухудшению прогноза при ретрансплантации в случае помутнения первичного трансплантата.
Послойно-сквозные (обычно грибовидные) кератопластики совмещают в себе качества тех и других - "шляпка гриба" замещает передние или задние слои роговицы, а "ножка гриба" делает трансплантат сквозным. Если "шляпка гриба" обращена кпереди, такой "гриб" называют передним, если же "шляпка гриба" обращена кзади (в сторону передней камеры глаза), то "гриб" называют задним.
В зависимости от цели операции кератопластики бывают оптическими, лечебными и косметическими. Предназначение первых очевидно - их непосредственной целью является восстановление (или улучшение) прозрачности роговицы и повышение остроты зрения. К лечебной кератопластике прибегают при прогрессировании заболевания или повреждения роговицы в случаях безуспешности консервативной терапии. Косметические операции направлены на улучшение внешнего вида роговицы и восстановление (реконструкцию) ее врожденных или приобретенных после травм и болезней дефектов и деформаций.
Вместе в тем нужно признать, что такое деление является условным, так как оптическая кератопластика очень часто применяется при заболеваниях глаз (например, дистрофиях), а также, в конечном счете, может оказывать лечебное воздействие на окружающие ткани (эффект просветления мутной роговицы, по соседству с прозрачно прижившим трансплантатом). Лечебная кератопластика в части случаев со временем может дать оптический эффект. Кроме того, оптическая и лечебная кератопластики также способствуют улучшению внешнего вида глаза и субъекта, восстановлению роговицы после дефектов (язва, рана), деформаций (рубцы, эктазии, опухоли, абсцессы) , то есть приводят к косметическому эффекту. В свою очередь косметические операции также могут способствовать оптическому и лечебному эффекту.
При определении показаний к тому или иному способу операции всякий раз необходимо соизмерять, в какой мере степень риска оправдывает ожидаемый результат намеченного вмешательства, вероятностью и тяжестью встречающихся при нем осложнений. Послойные пересадки технически более простые и всегда связаны с меньшим риском чем сквозные. Исключением является задняя послойная кератопластика, которая не только более трудоемка, но и технически более сложна по выполнению.
Точная локализация изменений роговицы по глубине, как известно, осуществляется с помощью биомикроскопии, также в настоящее время максимальный объем информации с точность до нанометров дает ОКТ роговицы. Дополнительную информацию, позволяющую скорректировать план предстоящей операции и прогнозировать ее исход, получают с помощью ультразвуковой эхобиометрии, электрофизиологического исследования, диафаноскопии, тонометрии.
В самом общем виде основанием для оптической кератопластики служат патологические изменения в роговице, которые из-за стойкого ее помутнения сопровождаются значительным снижением зрения, нарушающего способность к труду или самообслуживание в быту, при обнадеживающих результатах прогностических тестов на сохранность зрительной рецепции. Для кератопластики с оптической целью часто выбирают вариант сквозной, поскольку при послойной операции рассчитывать на очень высокие визуальные результаты (из-за легкого помутнения, неизбежно возникающего на границе слоев собственной и пересаженной ткани) не всегда можно. Тем не менее, в силу гораздо меньшего риска послойной пересадки, по сравнению со сквозной, и к первой существуют "оптические показания", особенно в случаях единственного зрячего глаза.
Мутное приживление трансплантата после первой операции не исключает повторных оптических кератопластик или кератопротезирования. В этих случаях, если оптического эффекта достичь не удается, но анатомические взаимоотношения мутной роговицы и соседних тканей улучшаются (устраняются синехии, улучшается сферичность роговицы и пр.), первая операция может рассматриваться как лечебно-реконструктивная. В общем виде для лечебных кератопластик показания могут быть сформулированы следующим образом. К данной операции прибегают при патологических процессах (плюс - или минус - ткань) в роговице, не поддающихся консервативным методам лечения и угрожающих из-за прогрессирования гибелью глаза, понижением остроты зрения , частыми рецидивами заболевания, проявляющихся изнурительным роговичным синдромом раздражения глаза, в том числе болями.
Лечебная кератопластика как ургентная операция показана при свежих прободных ранениях роговицы с дефектом ткани, при тяжелых и особо тяжелых ожогах глазного яблока (после некрэктомии и в сочетании с так называемыми васкуляризирующими операциями).
Косметические кератопластики объединяют две группы операций, направленных как на улучшение внешнего вида глаза, так и на реконструкцию роговицы при врожденных и приобретенных аномалиях, дефектах и деформациях. В настоящее время косметические операции первой группы, производимые, как правило, на слепых глазах, и преследующие только одну цель - улучшение внешнего вида - применяются крайне редко, так как этого же можно достигнуть путем использования косметических контактных линз и тонкостенных глазных протезов. Кератопластические операции второй группы, в свою очередь, делятся на две подгруппы: собственно восстановительные (реконструктивные) и рефракционные.
Рефракционная кератопластика выделена в отдельную подгруппу не случайно, так как в отличие от всех остальных кератопластик рефракционная кератопластика производится на прозрачной, неизмененной роговице глаза, имеющего врожденную или приобретенную аномалию рефракции. Среди всех косметических операций именно рефракционная кератопластика получила наибольшее распространение.
Прогноз операции
Имеющиеся и ожидаемые зрительные функции.
Помутнение роговицы, возникшее в раннем детстве, и связанная с этим амблиопия от неупотребления (ex anopsia), нистагм или врожденное косоглазие - плохие прогностические признаки, хотя, конечно, и в этих случаях абсолютных противопоказаний к операции не имеется.
Учитывая, что после кератопластики, особенно сквозной, зрение в силу ряда осложнений может не только не улучшиться, но даже ухудшиться - не следует производить эту операцию с оптической целью, если острота зрения лучшего глаза составляет 0,1 и более. При таком зрении иногда возможно вернуть способность к письму и чтению без операции, а также с помощью телескопической или иной коррекции. Лечебная же кератопластика в ряде случаев (при рецидивирующем птеригиуме) производится даже при зрении 1,0.
При наличии предметного зрения важно составить представление о поле зрения, так как даже при самой успешной кератопластике рассчитывать на его расширение практически не приходится. В случае отсутствия предметного зрения приходится ориентироваться на способность воспринимать цвета, на результаты пробы Примроза (с палочкой Меддокса), итоги энтоптических и электрофизиологических исследований. При правильном цветовосприятии, безошибочном узнавании положений светящейся полоски, образуемой при засвете глаза через папочку Меддокса (в пробе Примроза), при наличии ощущения фигур сосудистого дерева сетчатки в ходе аутоофтальмоскопии (по Пуркинье), наконец, при нормальных порогах электрической чувствительности зрительного нерва (до 6 V) и высокой частоте исчезновения электрического фосфена - после успешной кератопластики можно рассчитывать на достаточно высокое центральное зрение.
Об отсутствии отслойки сетчатки и перспективах на хорошее поле зрения могут свидетельствовать положительные во всех четырех исследуемых квадрантах глазного яблока феномен диасклерального просвечивания и механофосфены.
Немаловажную роль играет также нормальная электроретинограмма (при амплитуде волны b не менее 150 мкв). Наличие правильной формы общей (ганцфельд) электроретинограммы (ЭРГ) с амплитудой волны b не менее 2/5 от нормальной свидетельствует о функциональной сохранности достаточной для получения предметного зрения части сетчатки. При отсутствии общей ЭРГ целесообразна регистрация ритмической электроретинограммы (рЭРГ, фликер) на частоте стимула 30 Гц. Если при этом имеет место воспроизведение сетчаткой ритма стимуляции (даже при небольших значениях амплитуд потенциалов), то можно говорить о сохранности части колбочкового аппарата сетчатки. Во всех случаях целесообразна регистрация зрительных вызванных потенциалов (ЗВП). Отсутствие ЗВП будет являться крайне неблагоприятным прогностическим признаком для послеоперационных зрительных функций.
Весьма обнадеживает способность правильно проецировать свет, так как это, зачастую, позволяет исключить нейроофтальмологическую патологию, в частности атрофию зрительного нерва. При значительных нарушениях хотя бы одного из вышеперечисленных тестов показания к кератопластике хотя и сохраняются, но прогноз в отношении повышения зрения становится сомнительным.
Состояние офтальмотонуса.
Офтальмогипертензия и даже глаукома на глазах с бельмами могут протекать довольно незаметно, и поэтому возможность их наличия необходимо специально исключить еще до кератопластики. Дело в том, что существующие в глазу нарушения гидродинамики могут свести на нет результаты даже отлично выполненной кератопластики. В части случаев органические причины, вызывающие периодические повышения офтальмотонуса могут быть легко устранены в ходе кератопластики, производимой со вскрытием глаза (рассечение синехий, ликвидация зрачкового блока и др.). Естественно, никаких оснований при этом не остается к производству специальных гипотензивных вмешательств.
Другое дело, если уже сформировался весь симптомокомплекс глаукомы, то еще до кератопластики (особенно сквозной) необходимо производить одну из современных антиглаукоматозных операций: синусотрабекулоэктомию при открытом угле передней камеры, базальный клапанный иридэнклейзис при закрытом угле, трепаноциклодиализ в случае афакии, дренирование эксплантом передней или задней камер глаза, если сильно изменена (например, при ожоге) радужка, циклокриопексия - при выраженной гиперпродукции камерной влаги. С внедрением в клиническую практику лазеров возможность антиглаукоматозной хирургии повысилась. Однако, производство лазерной иридо- или гониопунктуры при бельмах, не позволяющих видеть радужку, как правило, весьма затруднительно.
Состояние бельма или пораженной зоны роговицы и соседних с ними тканей.
При оптической кератопластике, прежде всего, исключительно важными являются этиология помутнения и возможность его дальнейшего развития.
Если помутнение стационарное (бельмо) и не имеет тенденции к дальнейшему развитию, можно рассчитывать на хороший исход. Самыми благоприятными являются помутнения роговицы как исход перенесенных в прошлом воспалительных заболеваний и механических травм , если они не сопровождаются обильной васкуляризацией, наличием передних и задних синехий, а также если бельмо довольно ограничено по размерам и занимает центральную зону. В этом случае при операции можно использовать трепан диаметром, не превышающим диаметр бельма.
В прогностическом отношении наименее перспективны для оптической кератопластики помутнения, возникшие в роговице после тяжелых ожогов. Роговица при этом обычно страдает по всей площади, она либо очень истончена, либо, наоборот, чрезмерно утолщена, обильно васкуляризирована, лишена чувствительности, ткань ее грубо перерождена в рубцовую.
Благоприятный прогноз для оптической кератопластики имеется и при семейно-наследственных дистрофиях роговицы, в том числе при кератоконусе и других эктазиях. Объясняется это медленным (годы и десятилетия) течением заболевания и поражением преимущественно центральной зоны роговицы. Однако пересаживаемый роговичный трансплантат должен располагаться в пределах здоровой ткани.
Прогноз операции значительно осложняется, если помутнение возникло на почве вторичной дистрофии, особенно эндотелиально-эпителиальной. В этих случаях оптическая кератопластика показана только в терминальной стадии заболевания.
При лечебной кератопластике помимо этиологии заболевания (бактериальное, вирусное, грибковое и т.д.) и характера травмы (физический или химический) необходимо учитывать площадь и глубину поражения роговицы и, возможно, склеры, длительность патологического процесса, наличие (глубину) или отсутствие передней камеры, ее содержимое, состояние радужки, зрачка, хрусталика, стекловидного тела, ресничного тела, сосудистой, сетчатки. Наличие спаек между роговицей и радужкой может существенно осложнить течение и исход сквозной и задней послойной кератопластики. Устранить спайки до операции, как правило, не представляется возможным, но в процессе кератопластики их следует обязательно ликвидировать. С целью предупреждения повторной подпайки радужки к роговице целесообразно с учетом локализации синехий производить базальную иридэктомию.
Необходимо помнить, что при лечебной кератопластике трансплантат должен размещаться в пределах здоровой ткани, так как только в этом случае можно рассчитывать, в первую очередь, на лечебный эффект. Несоблюдение этого крайне важного правила приведет к рецидиву заболевания, гибели или перерождению пересаженного трансплантата.
Состояние хрусталика и стекловидного тела.
Мутный хрусталик в ходе сквозной или задней послойной кератопластик целесообразно удалить, для чего требуется предусмотреть трепан достаточных размеров (у людей старше 40 лет желательно не менее 6 мм). При подвывихе хрусталика приходится производить его интракапсулярную экстракцию. Если же хрусталик расположен на своем обычном месте и задняя часть его капсулы не повреждена, целесообразно ограничиться экстракапсулярной экстракцией. Через трепанационное отверстие не только выводят хрусталик (либо иссеченную часть передней капсулы, ядро и хрусталиковые массы), но при необходимости также имплантируют интраокулярную заднекамерную линзу.
Начальные помутнения хрусталика, естественно, не являются основанием для его экстракции. Вместе с тем нужно помнить, что после кератопластики уже имеющиеся в хрусталике помутнения могут заметно усиливаться.
Принято рассматривать состояние афакии неблагоприятным моментом для сквозной кератопластики. Однако дело не в самой афакии, а в наличии сращений стекловидного тела с роговицей и, как следствие, развитие вторичной эндотелиально-эпителиальной дистрофии роговицы. Чтобы улучшить прогноз кератопластики нужно принять меры к освобождению передней камеры от тяжей стекловидного тела, подпаянных к роговице.
Витреокорнеальное сращение может возникнуть и при наличии хрусталика, если он смещен со своего места, а дислоцированное в переднюю камеру стекловидное тело достигает зоны роговицы, лишенную эндотелия. Мутное стекловидное тело также подлежит удалению. При перфорирующих видах кератопластики витрэктомию лучше производить в ходе одной операции методом "открытое небо". Наличие прозрачного хрусталика или хотя бы только прозрачной задней его капсулы позволяет отсрочить операцию на 3-6 месяцев и после улучшения прозрачности роговицы производить витрэктомию уже закрытым способом через плоскую часть ресничного тела.
Состояние век, конъюнктивы, слезопродуцирующей и слезоотводящей функций.
Неполное смыкание век при их рубцовой недостаточности или паралитическом лагофтальме должно насторожить хирурга, планирующего операцию. После кератопластики он может оказаться перед необходимостью проведения блефарорафии. Иногда предпочтительнее выполнить пластическую операцию на веках или конъюнктиве. При частичном анкило- или симблефароне кератопластику обычно сочетают с пластическими операциями на конъюнктиве и коже век. Если имеется трихиаз, он должен быть обязательно устранен еще до кератопластики.
Кератопластика может быть обречена на неудачу также при резко замедленном слезообразовании, поэтому при синдроме "сухого глаза" (синдром Съегрена) пересадке роговицы нужно предпослать другие вмешательства, нацеленные на восстановление нормальной смачиваемости глаза (при недостаточности функции слезных желез - коагуляция слезных точек, при полном отсутствии слезопродукции - пересадка в конъюнктивальный мешок выходного конца общего слюнного протока). Для оценки слезообразующей функции пользуются тестом Ширмера.
Нарушение слезоотведения, проявляющееся в жалобах на слезотечение, не являются препятствием к кератопластике. Однако в этих случаях совершенно необходимо исследовать содержимое конъюнктивальной полости на микрофлору. Наличие обильного роста микроорганизмов на питательных средах потребует санации слезоотводящих путей (при хроническом гнойном дакриоцистите необходима операция - дакриоцисториностомия).
Если же патологический процесс угрожает гибелью глаза, то лечебная кератопластика при таких состояниях может производиться даже при гнойном воспалении в слезном мешке, однако, в этом случае перед трансплантацией необходимо перевязывать слезные канальцы и хорошо санировать конъюнктивальную полость.
Острые воспалительные заболевания конъюнктивы и роговицы служат противопоказанием для кератопластики, планируемой с оптической целью. Однако, в ряде случаев, лечебная кератопластика может быть весьма эффективным методом лечения тяжелых воспалительных заболеваний роговицы, лимба и конъюнктивы, протекающих с изъязвлением, в том числе при гнойной инфекции.
Потенциальные мишени для таргетной иммунотерапии кератопластики «высокого риска»
В настоящее время применяются различные хирургические и терапевтические подходы по снижению риска отторжения аллотрансплантатов роговицы при кератопластике. Предлагаются варианты малой иммуносупрессивной терапии посредством сотрансплантации аллогенных фрагментов лимба с иммуносупрессивными свойствами.
Одним из методов иммуносупрессивной терапии является применение глюкокортикоидов и селективных препаратов. Большой интерес представляют препараты, действие которых направлено на регуляцию или блокаду иммунологических процессов воспаления и отторжения. Например, Такролимус – макролидный антибиотик, член семейства ингибиторов кальциневрина. Препарат супрессирует начальную фазу активации Т-лимфоцитов, что приводит к ингибированию транскрипции IL-2, а также влияет на высвобождение цитокинов (TNF-α, IFN-γи др.).
Успешно применяются для профилактики и лечения неоваскуляризации роговицы некоторые анти-VEGF-A-препараты. Клинические исследования бевацизумаба продемонстрировали безопасность и многообещающие результаты у пациентов после сквозной кератопластики.
Вышесказанное позволило выявить потенциальные мишени для иммунотерапии кератопластики «высокого риска», которые могут послужить основой для разработки новых стратегий ведения пациентов данной группы.
Известно, что при трансплантации различных органов у пациентов с признаками воспаления ингибирование продукции интерлейкина 1 (IL-1) помогает подавлять симптомы воспалительного процесса. Особое значение имеет IL-1β, индуцирующий синтез других провоспалительных цитокинов (например, TNF-α и IL-6), медиаторов воспаления (NO и простагландины) и хемокинов. Высокий уровень IL-1β в сыворотке крови (более 30 пкг/мл) и/или в слезной жидкости может служить прогностическим признаком отторжения кератотрансплантата. В исследовании M. Tahvildari и соавт. (2016) показано, что системное введение низких доз IL-2 увеличивает количество регуляторных Т-лимфоцитов и способствует приживлению трансплантата. Интелейкин 6 (IL-6) в присутствии TGF-βингибирует дифференцировку Treg-клеток, способствуя развитию Th17 в реакциях отторжения кератотрансплантата. Интерлейкин 17А (IL-17A) влияет на индукцию IL-6, IL-8 и простагландина E2 (PGE2), а также усиление экспрессии молекулы межклеточной адгезии ICAM-1 в фибробластах и кератиноцитах. IL-17A индуцирует секрецию макрофагами TNF-α, IL-1 и стромелизина.
Известна прогностическая роль маркера активации T-лимфоцитов (CD30) при оценке послеоперационных осложнений пересадки почки: острое отторжение аллотрансплантата наблюдалось у реципиентов с высоким уровенем sCD30 в плазме в течение первых 3–5 дней после трансплантации.
В исследовании P. Maier и соавт. (2011) у 18 пациентов перед сквозной кератопластикой были определены уровни 6 цитокинов в водянистой влаге. Достоверными предикторами иммунной реакции отторжения в послеоперационном периоде стали IL-4, IL-2, IL-5 и IFN-γ.
В экспериментальной модели реакции отторжения (сквозная ксенотрансплантация роговицы) наиболее значимыми биомаркерами для прогнозирования отторжения были уровни C3a, CD8 (корецепторов Т-киллеров) и интерферона IFN-γ (фактора врожденного и адаптивного иммунитета) в водянистой влаге. С3а является эффектором системы комплемента, выполняющим функции Т-клеточной и макрофагальной активации, стимуляции ангиогенеза, хемотаксиса, дегрануляции тучных клеток. Интерфероны способны усиливать экспрессию молекул системы HLA, стимулировать продукцию IL-1βи IL-2, активировать клетки-киллеры, тем самым приводя к развитию аутоиммунных реакций и отторжению трансплантата.
Отдельного внимания заслуживает генная терапия, направленная на модуляцию Т-клеточного иммунного ответа, развивающегося при трансплантации роговицы. Созданы модифицированные аллогенные композитные трансплантаты для ограничения экспрессии p35. В результате уменьшение числа праймированных CD4+ T-лимфоцитов было подтверждено значительное снижение пролиферации и более низкий уровень секреции IFN-γв сравнении с контрольными группами.
Трансплантационный материал
Роговичная ткань, используемая для пересадки роговицы, может быть аутологичной, изогенной, аллогенной, ксеногенной.
Аутологичные ткани (собственные ткани реципиента) были бы наиболее подходящими для трансплантации роговицы, однако в практической офтальмологии они применяются довольно редко. Возможность их применения ограничивается рефракционной кератопластикой (кератомилез) и теми эксквизитными случаями, когда второй глаз больного оказывался слепым (терминальная глаукома, тотальная многократно и неуспешно оперированная отслойка сетчатки, атрофия или перерыв зрительного нерва), но имел хорошую роговицу.
Чаще аутотрансплантация с оптической целью применяется в пределах одного и того же глаза, когда при необширных центральных бельмах имеется прозрачная ткань на периферии роговицы. Путем поворота эксцентрично выкроенного роговичного диска или путем перемены местами мутного и прозрачного участков достигается желаемый оптический эффект.
Изогенные ткани - ткани трансплантируемые между однояйцевыми близнецами. Будучи одинаковыми в генетическом отношении и имея один и тот же набор антигенов они полностью совместимы в иммунологическом отношении. Однако применение таких тканей может носить только казуистический характер, так как у пострадавших практически не встречаются братья и сестры - близнецы, способные быть донорами.
Аллогенными для человека являются ткани другого человека. Длительное время трансплантация роговиц оставалась эксклюзивным, носящим эпизодический характер, вмешательством, осуществляемым сразу же после изъятия трансплантата у донора, погибшего в результате несчастного случая. Однако этого было явно недостаточно в связи с большим количеством больных, ожидавших кератопластику. Офтальмология остро нуждалась в более доступном доноре, разработке различных методов консервации роговицы и в создании запаса роговичного материала.
Интеллектуальным отцом сегодняшних глазных банков во всем мире признается акад. В. П.Филатов (Одесса), который уже в 1934 году сообщил о возможности забора глаз у кадавера (через несколько часов после наступления смерти), с последующей обработкой их раствором бриллиантовой зелени и сохранением при температуре 2-4°С в закрытом стеклянном сосуде. Такое, проводимое до 1-3 суток хранение во влажной камере оставалось методом выбора в течение нескольких десятилетий.
Основная цель консервирования ткани, как способа сохранения ее для последующей кератопластики, состоит в торможении процессов аутолиза и ослаблении антигенных свойств в трансплантационном материале. Сами же методы консервирования роговиц должны удовлетворять следующим основным требованиям: быть простыми и дешевыми, универсальными (пригодными для всех видов кератопластик), как можно меньше нарушающими жизнедеятельность роговичной ткани.
До настоящего времени в нашей стране и за рубежом продолжают использовать роговичные трансплантаты обезвоженные над силикагелем. Простота метода, длительность сроков хранения, позволяющая накапливать трансплантационный материал, легкость транспортировки являются подкупающими достоинствами для использования такого материала по неотложным показаниям. Вместе с тем, обезвоженные трансплантаты лишены жизнедеятельности и, в первую очередь, эндотелиальной выстилки. Рассчитывать на их истинное прозрачное приживление не приходится. Поэтому после регидратации этот материал может быть использован только для передней послойной кератопластики в варианте частичной и почти полной преимущественно не с оптической, а с лечебной целью. При угрозе или развитии перфорации роговицы в результате тяжелых и особо тяжелых ожогов глаз данные трансплантаты могут использоваться как биологическая повязка при васкуляризирующих операциях.
Наиболее перспективным способом длительной консервации роговиц для послойной и особенно сквозной кератопластики является низкотемпературное (-196°С) содержание их в жидком азоте с использованием различных криопротекторов. Так замораживание роговиц с каймой склеры, помещенных в 10% раствор криопротектора полиэтиленоксида молекулярной массы 400, производится по двухэтапной программе со скоростью охлаждения на 1-м этапе 1-2 град/мин до начала кристаллизации и на 2-м этапе - 300-400 град/мин до -196°С. Такая программа способствует сохранению структурно-функциональных свойств ткани роговицы. Биологические и оптические результаты кератопластики, полученные при использовании консервированных таким образом трансплантатов, не уступают в ряде случаев свежеконсервированным. Поэтому криоконсервация обещает стать единственным методом консервации роговиц с неограниченным сроком хранения. Однако, дороговизна методики и возникающие повреждения (хотя и обратимые) эндотелиальных клеток, препятствуют широкому внедрению в клинику данного метода консервирования.
Единственным надежным, но дорогостоящим методом, позволяющим сегодня сохранять роговицы до 35 дней, является хранение в среде для культуры органов в условиях термостата (t= 32-37°C), заполненного для создания буферных свойств среды 5% углекислым газом.
Преимуществами такого органного культивирования донорских роговиц в срок до 35 дней являются:
- постоянное наличие трансплантатов от доноров, погибших в результате несчастных случаев;
- многократный контроль стерильности;
- многократная оценка состояния эндотелия;
- посмертное HLA-типирование.
В настоящее время в России отсутствует (надо полагать, что временно) законодательная база, предписывающая правила забора донорского трансплантационного материала, включая роговичный. Соответственно отсутствуют и противопоказания для забора роговиц. А они очень важны как для безопасности персонала банка и больного, так и для правильного выбора донорской роговицы и исхода кератопластики. Поэтому со списком важнейших "противопоказаний для использования роговиц" лучше ознакомиться на основании существующего в Европе (принят в январе 1990 г. на 3-ей Европейской конференции банков роговиц).
|
Противопоказания для использования донорских роговиц (принято Европейской конференцией по банкам роговиц, Ляйден, 1990). |
|
|
Заболевания, которые могут подвергнуть опасности даже персонал банков роговиц |
|
|
Заболевания, которые могут подвергнуть опасности реципиента роговичного трансплантата |
|
|
Причины, исключающие донорство роговицы из-за плохого ее качества |
|
Преклонный возраст донора не является критерием к исключению забора, но лучше его ограничить 65 годами. Решающим все же является исследование качества эндотелия. Однако разница в возрасте донора и реципиента не должна превышать 30 лет. Возраст донора, по возможности, не должен быть меньше 2-х лет, чтобы избежать значительной миопизации реципиента при сквозной кератопластике. Конечно, это не имеет значения при трансплантации у младенцев или маленьких детей.
По возможности, не следует превышать интервал в 50 часов между остановкой кровообращения и энуклеацией, хотя при хранении трупа в холодильнике, посмертное время хранение до 72 часов совместимо с успешным культивированием органа.
Ксеногенные ткани - ткани, полученные от животных. Будучи самыми доступными, они применялись на первом этапе развития пересадки роговицы. Интерес к ним пропал, так как все трансплантаты из ксеногенных тканей либо мутнели, либо отторгались. Причина этого, по общему признанию, лежит в иммунобиологическом конфликте (несовместимости) между тканями донора и реципиента. Вместе с тем в последние годы к ним повторно возник интерес. Такая трансплантация с хорошим исходом возможна при выращивании специальных универсальных животных-доноров, близких в генетическом отношении к человеку, предоперационном воздействии на иммунный аппарат трансплантата, медикаментозной коррекции иммунного ответа в послеоперационном периоде.

